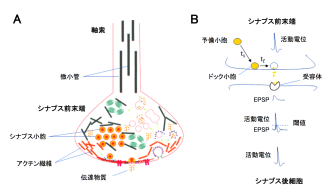
神経伝達のメンテナンスに関わる細胞骨格タンパク質
沖縄科学技術大学院大学(OIST)の細胞分子シナプス機能ユニットの研究者たちは、ラットの脳幹からスライスを作成して巨大シナプス前末端「ヘルドのカリックス」を可視化し、これまで不明であった細胞骨格タンパク質の役割を明らかにしました。
最初の発見は、江口工学研究員(現所属:ISTオーストリア)とローラン・ギヨー・グループリーダーの技術指導の下にOIST博士課程学生のラシュミ・ピリヤさんによってなされ、学位論文としてまとめられましたが、その後、ハンイン・ワン研究員が実験を追加して内容を固め、この度、Journal of Neuroscience誌に掲載されました。
神経疾患の原因につながるシナプス前末端の分子メカニズムを明らかにすることで、パーキンソン病やアルツハイマー病の発症メカニズムの理解を前進させることが期待されます

本研究で明らかになったことは次の3点です。
(1) シナプス前末端における微小管とシナプス小胞の共存
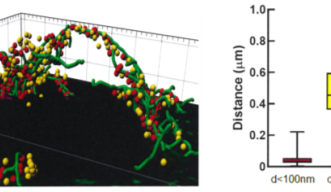
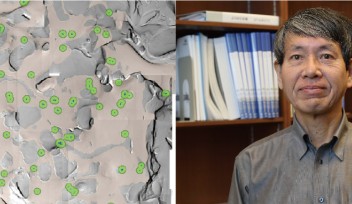
STED顕微鏡を使ってヘルドのカリックスを蛍光組織観察したところ、シナプス前末端内の小胞の約半数が微小管のごく近くに平均44 nmを隔てて存在すると計測されました(図2)。

(2) アクチン繊維と微小管はそれぞれシナプス小胞の高速、低速補充に関わる
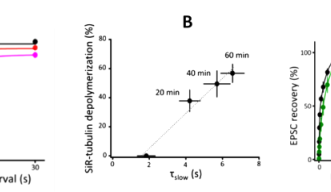
シナプス小胞が末端膜にドックした後、放出部位において伝達物質を放出すると、空白になった放出部位にドック小胞が速やかに補充され(時定数tf 0.2秒)、次いで、空白になったドック部位に予備小胞が比較的ゆっくりと(時定数ts 2秒)補充されます。今回の実験で、微小管を脱重合すると、この遅い補充時間(ts)が延長することが見出されました(図3A)。また、補充速度は微小管の脱重合に相関することが確認されました(図3B、相関係数0.98)。一方、アクチン繊維を脱重合すると、即時補充時間(tf)が特異的に延長しま した(図3C)

小胞枯渇によるシナプス抑制後に、シナプス応答(EPSP/EPSC)が回復する時間経過。ここから小胞補充速度が算出される。微小管の脱重合はtsを特異的に延長させる(赤とピンク)。(B) 小胞補充速度と微小管脱重合程度の相関。 (C) アクチン繊維の脱重合は、即時補充速度(tf)を特異的に延長させる(緑)。
(3) アクチン繊維と微小管は高頻度シナプス伝達の持続を支える
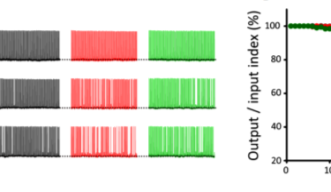
100 Hzで連続刺激しても、シナプス後細胞は、完全にフォローして少なくとも50秒間は活動電位を100 Hzで発生させます(図4)。しかし、微小管を脱重合したところ、後シナプスの活動電位が欠落するようになり、50秒後には40%が欠落しました。また、アクチン繊維の脱重合では20%が欠落しました。この実験結果からシナプス前末端の細胞骨格タンパク質が高頻度シナプス伝達の精度を維持することが明らかになりました。

今回の発見によって、神経疾患に伴うシナプス機能障害の原因を解明するための新たな材料が得られました。パーキンソン病やアルツハイマー病の発症に関わるアルファ・シヌクレインおよびタウ・タンパク質はいずれもシナプス前末端においてシナプス毒性を発揮することから、神経疾患の原因につながるシナプス前末端の分子メカニズムを明らかにすることは重要な課題です。