ヒト遺伝性失明の手がかりを魚の眼から探る
新生児は、ゲノム上の損傷や遺伝子突然変異により視力障害をきたし、先天性失明を発症するリスクを持っていることがあります。突然変異による視力障害の一種であるレーバー先天性黒内障(LCA)は、小児の失明で最も一般的な原因として挙げられ、視力障害全体の5%近くを占めています。この疾患は、両親が保有する眼の発生に関わる遺伝子に機能欠損が起きている場合、子供にも遺伝的に引き継がれ、発症に至るケースが知られています。しかし、LCAの病態の背景となる分子メカニズムはいまだ不明な点が多いのが現状です。今回、OIST神経発生ユニットの研究者らは、ヒト疾患研究のモデルとして優れているゼブラフィッシュを用いて、LCAにおける視細胞変性メカニズムの一端を明らかにしました。Scientific Reports誌 に掲載された本研究をもとに、研究者たちはゼブラフィッシュにおいて同疾患の原因解明に取り組み、ヒトLCAの治療に向けて新たな手がかりをもたらすことを目指しています。
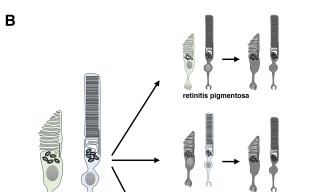
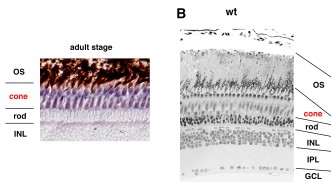
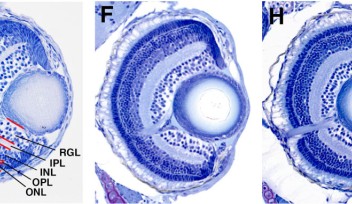
LCAでは網膜の機能が影響を受けることがわかっています。網膜は眼の奥にある薄い層状の神経組織で、光の感知や色の識別に働き、それらの視覚情報を視神経を通して脳に伝える役割を担っています。健全な網膜には、錐体および桿体と呼ばれる光を感知する2種類の光受容細胞があります。錐体は明るい環境において色覚をつかさどり、一方、桿体は薄暗い環境で明暗視を担います。夜に白黒のモノクロで物が見えるのはこの桿体の特性のためです。LCA患者の場合、錐体と桿体の形態異常や欠損を引き起こすため、光を感知できなくなります。これまでAipl1(aryl hydrocarbon receptor interacting protein like 1)と呼ばれる遺伝子を含む計24の遺伝子が、ヒトやマウスのLCAと関連することが明らかにされてきました。これらの遺伝子の1つに突然変異が生じると、正常な眼の発生が損なわれる、もしくは光受容細胞である錐体や桿体が変性を起こすことで、LCAを発症します。

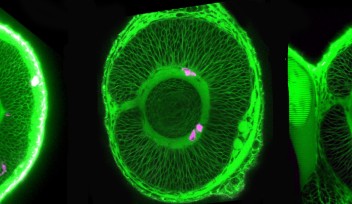
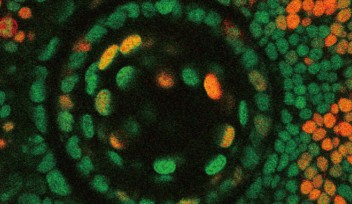
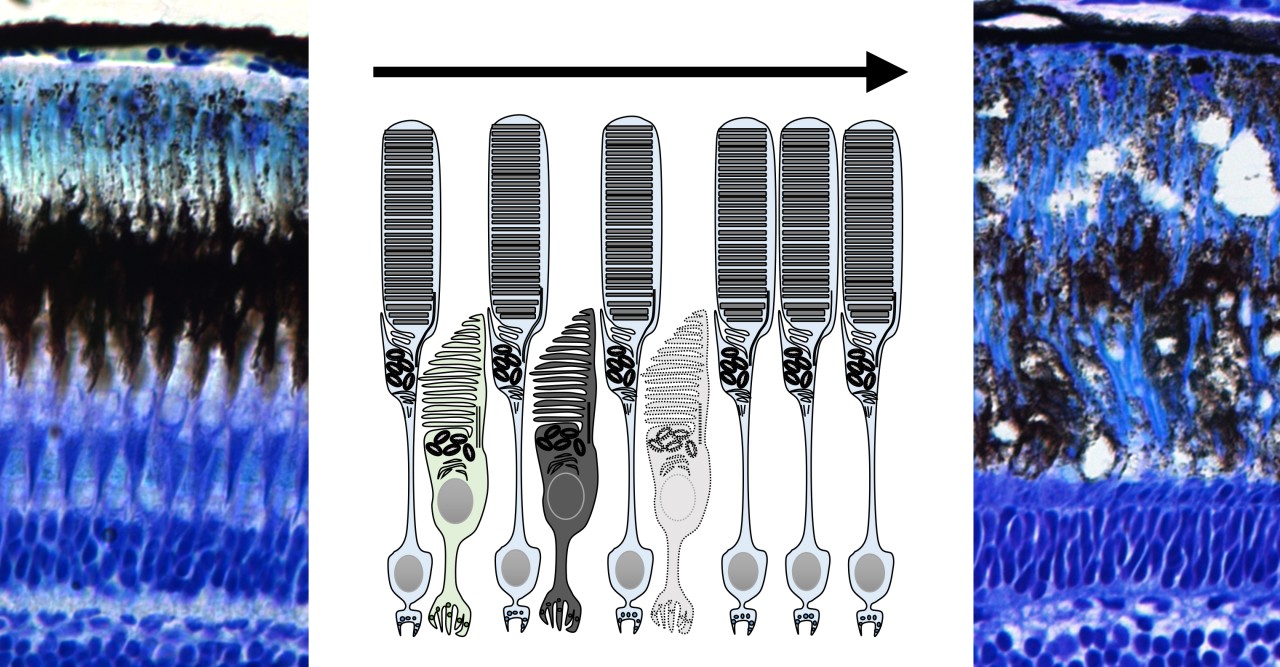
OISTの研究者らは、網膜において錐体の割合が高く、シンプルな装置で視力が測定できるゼブラフィッシュをモデル動物として選びました。この研究では、胚期において視覚反応を示さなかったゼブラフィッシュ突然変異体であるgold rush(gosh)に着目し、研究を行いました。ゼブラフィッシュのゲノムでは、Aipl1aとAipl1bと呼ばれる2つのAipl1遺伝子が存在し、それぞれ桿体と錐体で機能していることがわかりました。さらに、gosh突然変異体では、Aipl1b遺伝子に突然変異が起きており、錐体においてAipl1の機能活性が失われていることが明らかになりました。その結果、錐体が形態異常を示し、さらに進行性の細胞変性が起きることが観察されました。一方、桿体には影響がなく、細胞変性は錐体にのみ限局することが示唆されました。
論文著者らは研究をさらに掘り下げ、Aipl1がcGMPホスホジエステラーゼ6とグアニル酸シクラーゼという2つの酵素の安定性に不可欠であることも突き止めました。これらの酵素は、視細胞内で光刺激を電気信号に変換する光受容機構と呼ばれる過程を仲介します。これらの酵素がないと、光刺激の情報が視細胞で伝達されず、視神経を通して脳へ視覚情報が伝わらないため、ゼブラフィッシュは光刺激に反応できなくなります。
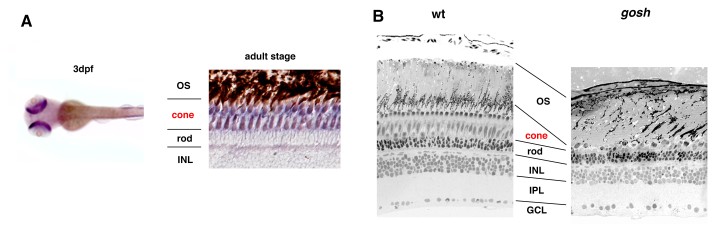
本研究により、ゼブラフィッシュにおいてAipl1b遺伝子が視覚機能と錐体の維持に重要であることが示唆されました。同遺伝子が欠損すると、錐体は光刺激を感知できず発生段階で変性してしまいます。これらの知見はヒトのLCA治療法を開発する糸口となると期待されます。本論文の筆頭著者であるマリア・イリバルネ博士は、「分子レベルや細胞レベルにおける錐体の細胞死のメカニズムや、ヒトLCAの病理学的プロセスを明らかにする上で、gosh変異体は優れたモデルです。この新たな知見が、将来、LCAのような辛い病気で苦しんでいる方々のために治療法を見いだす助けとなればと願っています」と語りました。