細胞死抑制チーム

人体の細胞には、自死または生存を促進する複雑な分子機構が存在し、自死と生存の狭間で揺れ動いているということが最近の研究で明らかになってきました。このような概念は、プログラム細胞死(PCD)として知られています。PCDが確認された2000年代初期には、PCDの引き金となる遺伝子および蛋白質の発見に研究の主眼があり、細胞の生存を促進するプロセスは、あまりよく分かっていません。
このたび、Scientific Reportsで発表された、沖縄科学技術大学院大学(OIST)の研究チームによる論文では、マウス細胞において、CCR4-NOT複合体を構成する蛋白質が、PCDの一種であるネクロプトーシスの制御に大きく関与していることを報告しています。「これは細胞死の仕組みを解明するための一歩です」と、山本雅教授率いる細胞シグナルユニットグループリーダーの鈴木亨博士は述べています。
自死プログラム
当初は、細胞には自死機構だけが存在すると考えられていたため、PCDの研究は、その大半がアポプトーシス(核DNA断片化と細胞収縮を特徴とする細胞の自壊プロセス)に関するものです。もう1つよく知られた細胞死プログラムとしては、細胞が自身の蛋白質をアミノ酸に分解して自食するオートファジーがあります。
10年ほど前に新たなタイプのPCDが発見され、アポプトーシスの特性(遺伝子レベルで厳密に制御されていることなど)とネクローシス(細胞膜が膨張後に破裂し、細胞間隙に内容物が漏出する炎症性細胞死)の特性を合わせ持っていることから、ネクロプトーシスと名付けられました。ネクロプトーシスは、細菌またはウイルスなどによってアポプトーシスが阻害された場合のフェイルセーフとして機能することができます。
PCDは、維持や分裂ができない古い細胞、または有害な可能性のある細胞を除去するとともに、生体の発育や組織の恒常性を維持するうえで重要な仕組みであり、自死プログラムが機能不全に陥ると、さまざまな事柄が破綻を起こしてしまいます。たとえば、PCDによる細胞の過剰な淘汰で神経変性が起こると、ハンチントン病、アルツハイマー病、パーキンソン病などの難病を発症します。PCDの仕組みを理解することは、前述した難病やさまざまな病気の治療法につながる可能性があります。

自死抑制複合体
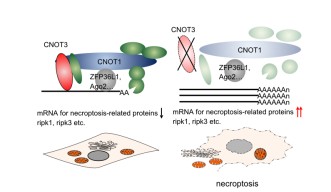
鈴木博士は、ネクロプトーシスの引き金となっている仕組みの候補として、メッセンジャーRNA(mRNA)の分解抑制を提唱しています。mRNAは、蛋白質のコード配列(メッセージ)を、細胞核から細胞質中のリボソーム(実際に蛋白質が合成される場)へと運ぶ役割を担っています。生成されたmRNAが細胞質中に存在し続ける限り、そのmRNAがコードする蛋白質のさらなる合成が可能なため、mRNAの寿命の制御が蛋白質合成をコントロールする手段になります。CCR4-NOT複合体は、mRNAを加工、質管理、およびポリA尾部(mRNA分子末端に存在するアデニンのヌクレオチド鎖)の短縮によって分解することで、遺伝子発現を制御します。
CCR4-NOT構成蛋白質の1つであるCNOT3は、CCR4-NOTを制御するうえで重要な要素です。鈴木博士のグループが行った実験では、マウス細胞中でのCNOT3抑制がネクロプトーシスを誘導することが明らかになりました。CNOT3欠損細胞では、RIPK1およびRIPK3(ネクロプトーシスに直接関連する蛋白質)をコードするmRNAの安定性と発現が増大することで、細胞死の引き金となる蛋白質が合成され、細胞死が誘導されます。こうした研究結果は、リウマチ性関節炎や乾癬などの壊死性細胞死をともなう一部のヒト炎症性疾患が、CCR4-NOT複合体の調節不全に起因している可能性を示しています。
CNOT3以外のCCR4-NOT構成蛋白質について、CNOT3欠損細胞において解析した結果、CNOT3が複合体全体の構造的および機能的完全性を維持する不可欠な役割を担っており、細胞の生存能にとって極めて重要であることが示唆されています。通常の完全なCNOT3蛋白質単独でも、瀕死細胞の生存能と生育を助けることができますが、C末端アミノ酸(他の蛋白質がCCR4-NOT複合体に結合する部位)を欠損した変異体蛋白質では、細胞の生残性を高める能力が失われていました。

鈴木博士の研究は、細胞の生死は生存を促進する分子と死を誘導する分子のバランスで決定されることを示しており、双方の詳細な役割を理解することは不必要な細胞死または異常な細胞の生存を伴う疾患に対処するための一歩となります。
専門分野
研究ユニット
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム