酵母実験で明らかになった抗がんメカニズム
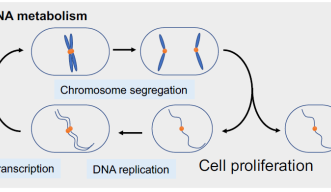
DNA鎖は、靴ひもや長いネックレスのように、絡み合ってほどけなくなることがあります。細胞分裂の際は、DNAが絡まることがないように、特殊な酵素が長くて複雑なDNAを絶え間なく仕分けしているのです。しかし、がん細胞ではこの安全装置が活発に働きすぎることで、がんが広がってしまいます。沖縄科学技術大学院大学(OIST)の研究者たちは、この酵素が分裂酵母内でどう働いているのか、そしてヒトのがんでこの酵素の働きを弱めるにはどうすればよいかという難題の一端を明らかにしました。
2019年1月11日にJournal of Biological Chemistry誌で発表された本研究では、がん治療の標的として知られているⅡ型DNAトポイソメラーゼ(略称トポⅡ)に着目しました。トポⅡは細胞分裂の過程で変化していくDNA鎖構造をうまく認識しながら、DNAのねじれや絡まりを解消しています。がん細胞では トポⅡの活動が増強され、それにより腫瘍の増殖が加速します。トポⅡを標的とする抗がん剤はこの酵素の機能を抑制し、がん細胞の複製とがんの広がりを阻害するのです。
しかし、トポⅡ阻害薬は十分な制ガン効果をもたらすとは必ずしもいえません。阻害薬を効果的に使うためには、トポⅡの働き方についての基礎的なメカニズムの解明が必要でした。
「多くの研究者がトポⅡの研究をしていますが、主にヒトの細胞や高等真核細胞を用いています」と語るのは、柳田充弘教授率いるOISTG0細胞ユニット所属の研究員であり、本論文の筆頭著者である中沢宜彦博士です。同博士によると、分裂酵母の細胞分裂メカニズムの大半はヒトに保存されており、実験操作も素早く容易に行うことができるため、分裂酵母内でトポⅡを研究することにしたとのことです。
「酵母内でトポⅡの働きを短期間で解析できれば、ヒト細胞にその知見を当てはめることができます。我々の研究によって、酵母がトポⅡ阻害薬のスクリーニングに適したモデルであり、臨床応用につながる有効な方法となり得ることがわかりました」と、中沢博士は述べています。
抗がん剤の有効性を高める
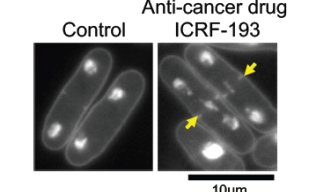
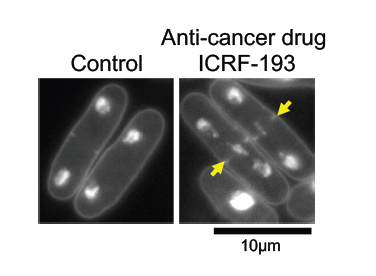
研究チームはトポⅡの分子レベルの働きを解明しようとしました。 高倍率の顕微鏡で見ると、トポⅡの役割ははっきりとわかります。トポⅡが正しく働いている細胞では、複製された2コピーの染色体DNAが、娘細胞の両極へ正常に分配されます。一方で、トポⅡを阻害すると染色体DNAは母細胞の中心で絡まってしまい、正しく二つの娘細胞に分配されません。
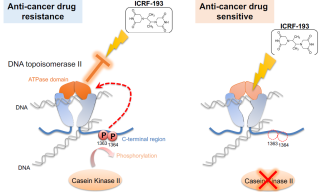
先行研究で、トポⅡはリン酸化、つまりタンパク質の特定の部位にリン酸基を付加させる反応を受けることがわかっています。分裂酵母とヒト細胞では、カゼインキナーゼⅡ(別名CKII)という酵素 が、トポⅡの特定領域をリン酸化します。今回、中沢博士らは実験でこの領域を特定し、一部の領域では細胞周期を通してリン酸化が続くことを発見しました。この恒常的な化学反応が、トポⅡの「ATP分解ドメイン」と呼ばれる領域の活動を増強するのです。博士らは当初、このリン酸化を観察したものの、これによってトポⅡの機能が実際にどう変化するかはわかりませんでした。

この謎は、トポⅡ阻害薬を細胞に処理することで解けました。阻害薬ICRF-193 は、トポⅡのATP分解ドメインの働きを阻害し、トポⅡとDNAを二度と離れなくすることで酵素反応を阻害します。しかしCKII によるリン酸化が起こると、ATP分解ドメインの働きが促進され、阻害薬は効力を失うのです。
「この(トポⅡのATP分解ドメインの)促進により抗がん剤の効果は低下します」と、中沢博士は話します。「もしこのリン酸化をブロックすることができれば、ATP分解ドメイン活性化は起こらず、薬の効力も保たれるのです。」

新たな治療法の基礎となる可能性
ヒト細胞内のトポⅡとCKIIの相互作用は、分裂酵母内と同様であることが報告されています。がん細胞ではトポⅡとCKIIの発現レベルが正常組織より高くなり、両酵素は細胞増殖に密接に関係しています。 酵母細胞内でのメカニズムが明らかになったことで、この知見が今後のヒトがん細胞の研究につながる可能性が出てきました。いつの日か、この研究が新たながん治療につながるかもしれません。
「もしCKIIとトポⅡを同時に阻害することができたら、がん細胞の分裂をはるかに効果的に抑制できるかもしれません。この相乗作用はがん治療において非常に有用となる可能性があります」と、中沢博士は語り、今後の発展へ期待をにじませました。