脳内の電気配線の謎に挑む
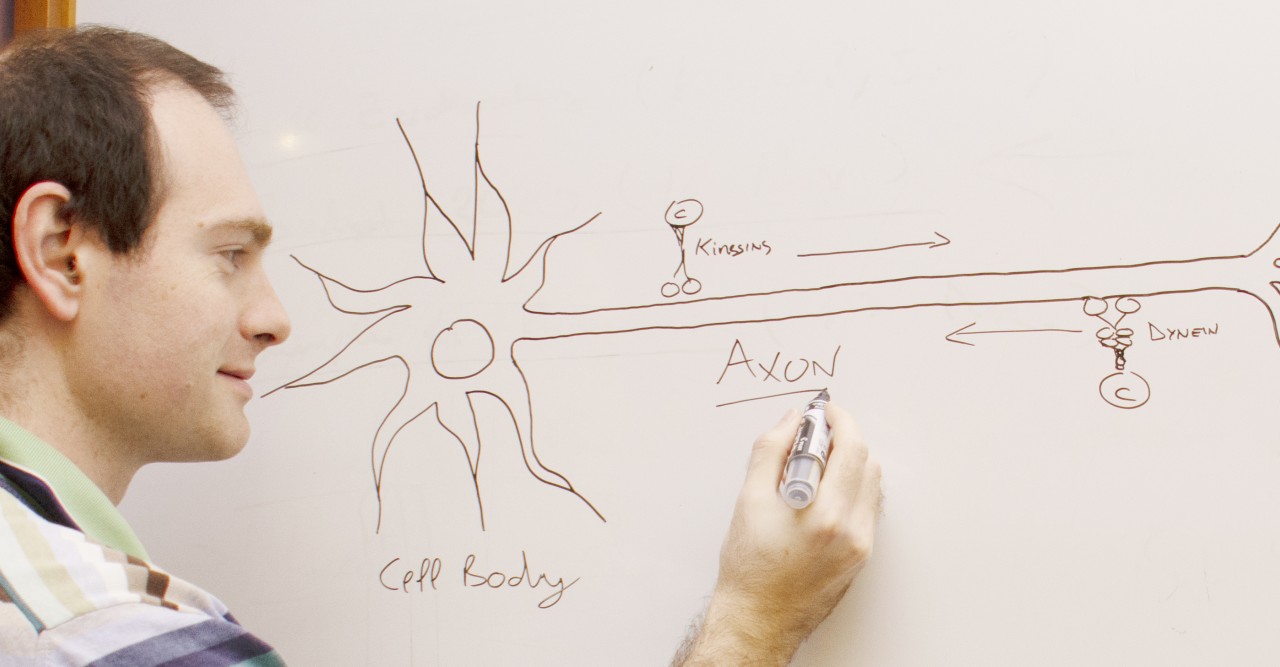
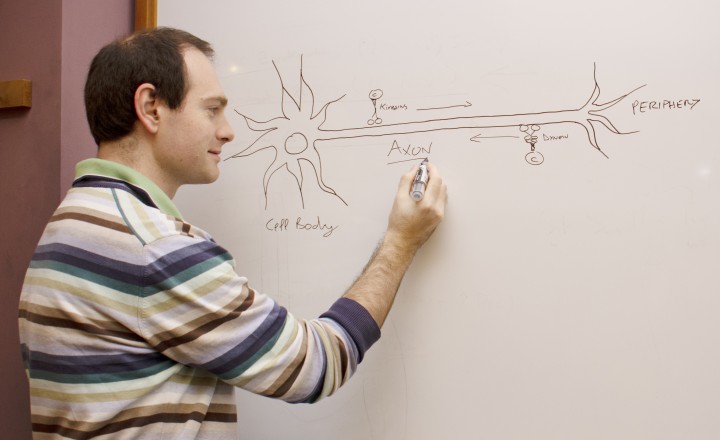
私たちの脳内にはニューロン(神経細胞)という電気配線があり、これが動作や思考、周囲の感知を可能にしています。ニューロンは迅速な情報伝達に特化し、特徴的な細長い形状をしています。ニューロンの最も長く細い部分は軸索と呼ばれ、細胞体からニューロンの先端に電気信号を伝えています。さらに軸索には分子輸送の高速道路としての第二の機能もあり、これはニューロンが正常に機能する上で重要な役割を果たしています。
沖縄科学技術大学院大学(OIST)に新設された分子神経科学ユニットを率いるマルコ・テレンツィオ准教授は、マウスモデルと培養ニューロンの実験を通して、物質の輸送における軸索の役割の解明に取り組んでいます。
「RNAやタンパク質、オルガネラ、そして、ニューロトロフィンと呼ばれる生存シグナルなど、あらゆる細胞の構成成分が軸索内を行き交っています。中には驚くほど長い軸索もあり、人間の場合は1メートルに達することもあります。それゆえ、ニューロンがどのように軸索内の輸送を可能にしているのかは注目に値するのです。」とテレンツィオ准教授は話します。
軸索輸送の障害は、パーキンソン病やアルツハイマー病、その他神経変性疾患の初期の兆候の一つです。したがって、この障害がどのように発生するかを解明し、輸送される物質を特定することができれば、これらの疾患の新たな診断法や治療法の開発につながる可能性があるとテレンツィオ准教授は期待しています。
ダイニンのサブユニット欠損が道をふさぐ
テレンツィオ准教授は2019年10月にOISTに着任する前は、イスラエルのワイツマン科学研究所でポスドク研究員として、ニューロンの先端から細胞体に向かって物質を逆行輸送するタンパク質「細胞質ダイニン」に関する研究を行っていました。
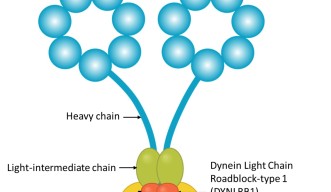
ダイニンは巨大で複雑なタンパク質であり、サイズで分類された複数のサブユニット(鎖)で構成されています。テレンツィオ准教授はワイツマン科学研究所の恩師であるマイク・ファインヅィルバー(Prof. Mike Fainzilber)教授と共同で、ダイニン軽鎖ロードブロックタイプ1(DYNLRB1)と呼ばれるダイニンのサブユニットの役割を研究しました。
「大きな重鎖の役割に関する研究は進んでおり、神経系の疾患は変異した重鎖が関係していますが、DYNLRB1などの小さな軽鎖はこれまであまり研究されてきませんでした。」とテレンツィオ准教授は話します。

Neurobiology of Disease誌に最近掲載された研究で、テレンツィオ准教授は、バランスと協調運動に関わる固有受容性ニューロンと呼ばれる特定の感覚ニューロンの中で、DYNLRB1を選択的に欠損させたマウスを作製しました。サブユニットが欠損しているため、マウスの脊髄神経の固有受容ニューロンの数は激減しました。また、マウスには歩行異常とバランス障害も現れたのです。
「研究結果は、DYNLRB1が固有受容ニューロンの生存と維持に不可欠であることを示しましたが、これは全くの予想外でした。非常に複雑な構造を持つダイニン分子モーターの中で、微細なサブユニットがこれほど重要な役割を担っているとは、通常は想像することはできません。」とテレンツィオ准教授は話しました。
DYNLRB1は、ダイニンを貨物に結合させるアクセサリータンパク質として機能すると考えられています。テレンツィオ准教授は、サブユニットがこれほど大きな影響を与えた理由が、ダイニンタンパク質の機能全体に影響を与えたからなのか、特定の物質の輸送のみに影響したからなのかを特定するために細胞培養したニューロンを調べたところ、後者であることがわかりました。
「どのような貨物であれ、DYNLRB1があれば基本的にダイニンに結合することができ、これが感覚ニューロンの正常な機能の維持に重要であるということは、非常に興味深いことです。次のステップは、この貨物の正体を明らかにすることです。」とテレンツィオ准教授は説明しました。
研究をさらに進めるため、現在OISTの分子神経科学ユニットでは、DYNLRB1と相互作用できる距離まで接近したタンパク質すべてをタグ付けする技法の開発に取り組んでいます。研究チームが目指すのは、DYNLRB1が輸送を助けるタンパク質を特定する技術の開発で、ニューロンの生存に必要な新しいシグナル伝達経路を示すことにつながるかもしれません。その後、これらの伝達経路が既知の神経変性疾患に関連しているかどうかを調べる計画です。

局所翻訳の中に見つかった生存と再生の秘密
テレンツィオ教授はまた、ニューロンの生存において重要であると考えられている局所翻訳という軸索メカニズムを研究しています。細胞は通常、コードされたRNA配列をアミノ酸配列に翻訳することによってタンパク質を合成します。通常このプロセスは核付近で発生すると考えられていますが、ニューロンについては必ずしもそうではありません。
「これまでの研究で、すべての翻訳がニューロンの細胞体で起きているわけではないことがわかっています。RNAの場合は、タンパク質が局所的に必要とされる場所まで軸索に沿って輸送され、そこでタンパク質の合成に使用されます。ニューロンなど大きな細胞では、よりエネルギー効率の良い方法であるかもしれません。」とテレンツィオ准教授は説明しています。
テレンツィオ准教授は、神経変性疾患において、また急性末梢神経損傷の後に局所翻訳がどのように起こるかを解明するため、ロンドン大学クイーンメアリー校、ワイツマン科学研究所、インペリアル・カレッジ・ロンドンや日本国内の研究者たちと共同研究を進めています。
これらの共同研究の一つでは、麻痺や死を引き起こす運動ニューロンの疾患である、筋萎縮性側索硬化症(ALS)の患者の皮膚細胞を初期化した人工多能性幹細胞を用いて、運動ニューロンを作製することを目指しています。患者由来の細胞を用いることで、マウスモデルよりも正確に疾患生物学を反映できるとテレンツィオ准教授は話します。
テレンツィオ准教授は、神経変性疾患の患者とそうでない人の運動ニューロンの軸索翻訳を比較することで、ニューロンの生存の基本メカニズムを解明し、疾患の初期徴候を検知する新たな検査法の確立を目指しています。
軸索の研究は、急性神経損傷への応用も期待されています。「軸索の翻訳は、ニューロンが損傷した後の再生プロセスを刺激する重要な役割を果たしています。合成タンパク質を研究することで、自然には再生できないニューロンでも、再生を促進できる化学物質を開発したいと考えています。これは、現在回復不能な神経損傷を持った人にとって、非常に大きな治療の可能性を秘めています。」とテレンツィオ准教授は期待を込めて話しました。
研究ユニット
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム