コエンザイムスイッチ:タンパク質結合コエンザイムを編集、両者の相互関係を初めて証明
本研究のポイント
核酸塩基を持つ有機分子構造である補酵素(コエンザイム)は、遥か昔、原始地球上に存在したと仮定されるRNAワールドより存在すると考えられており、このコエンザイムからタンパク質の起源と進化に関する情報が得られる可能性があります。しかし、コエンザイムとタンパク質の相互作用については、ほとんど解明されていません。このほど、沖縄科学技術大学院大学(OIST)の研究チームは、「ロスマンフォールド構造」をもつ酵素に着目し、タンパク質に対するコエンザイムの特異性が挿入や欠失によって形成されることを発見し、米国科学アカデミー紀要に掲載ました。本研究成果は、進化学分野において重要な発見であると同時に、コエンザイム特異性の編集の新たな戦略につながる可能性もあります。
研究について
コエンザイムは、タンパク質が触媒反応をする働きを助ける分子ですが、反応の半分はコエンザイムが貢献しています。この小さな有機分子には、私たちのDNAやRNAの構成要素と同じように、ヌクレオチドが含まれています。コエンザイムは、タンパク質の触媒反応に極めて重要な役割を果たしますが、その重要性はこれだけにとどまりません。核酸塩基を含むコエンザイムは、最古のタンパク質が誕生する以前にあったと考えられている太古のRNAワールドから存在している化石であると考えられています。ですから、コエンザイムは、タンパク質がどのように誕生し、進化してきたかを詳しく知るための手がかりとなる可能性があると考えられています。しかし、コエンザイムとタンパク質がどのように相互作用を進化させてきたのかについては、残念ながらあまり知られていません。
タンパク質の構造と機能は、アミノ酸配列にコードされていますが、いくつかの構造は、すべての生物の進化の過程で維持されてきました。その一つが、1970年にマイケル・ロスマン博士によって発見された「ロスマンフォールド構造」です。このタンパク質構造は、自然界に最も多くみられ、多様な触媒反応に関わっており、コエンザイムとタンパク質の相互作用の研究に相応しい研究対象となります。ロスマンフォールド構造のタンパク質は、構造のわずかな違いによって多様な触媒機能を発揮します。それは、構造の違いによってそこに結合して共に触媒として作用できるコエンザイムが変わるためです。
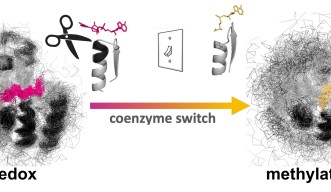
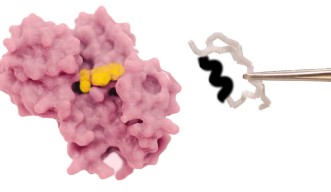
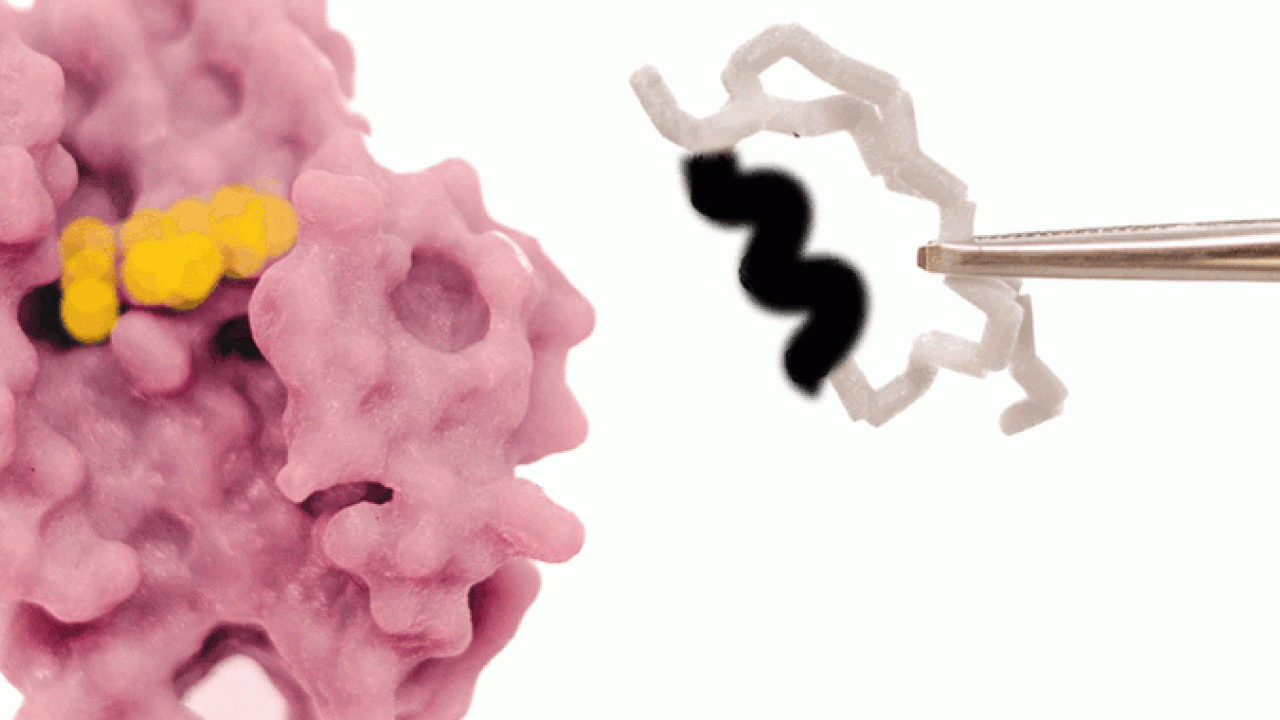
このほど、沖縄科学技術大学院大学(OIST)の研究チームは、自然に酸化還元反応を起こすロスマンフォールド構造のタンパク質を用いて、コエンザイムの結合ポケットを編集し、タンパク質をメチル化剤と結合させることに成功しました。天然のタンパク質は、コエンザイムのニコチンアミドアデニンジヌクレオチド(NAD)と結合しますが、この変異体はNADとの結合能力を失い、S-アデノシルメチオニン(SAM)との結合が可能となりました。本研究成果は、米国科学アカデミー紀要に掲載されました。


OISTタンパク質工学・進化ユニットを率いるパオラ・ラウリーノ准教授は、次のように述べています。「私たちは、原理を実証するため、酸化還元酵素タンパク質が本来のコエンザイムである NADではなくメチル化コエンザイムであるSAMと結合するように編集をしました。そのためには、太古から厳密に維持されてきたグリシンリッチループを編集する必要がありました。分子内に複雑な水素結合があるために容易でない作業ですが、これまでにも多くのタンパク質工学者が注目してきました。」
タンパク質の相互作用の先行研究では、単一または複数のアミノ酸を別のアミノ酸に置き換えて改変タンパク質を作り出す部位特異的変異導入法によって行われてきました。しかし、「挿入」や「欠失」(挿入欠失または「Indelインデル」)を利用する試みは、これまで十分に行われてきませんでした。挿入欠失は、アミノ酸の置き換えとは異なり、タンパク質配列に単一または複数のアミノ酸を追加したり、配列から取り除いたりするため、タンパク質の構造が大きく変わります。
研究チームは、まず初めに大規模な解析を行い、古来のコエンザイムであるNADの結合モチーフを、SAM結合モチーフに変形させるため、NADのコエンザイムポケットから3つのアミノ酸の挿入欠失を排除して、得られた変異体の構造を解明しました。予想通り、この変異体はSAM結合ポケットに特有の構造的特徴を示していました。
次に、この発見を検証するため、変異体とSAMの相互作用を調査することにしました。結合親和性を生物物理学的に測定する等温滴定熱量測定を行って変異体が実際に結合していることを確認しました。この結果から、コエンザイムの変更が成功したことが確認されました。また、コンピューターによるシミュレーションでも同様の結果が確認されました。
本研究論文の筆頭著者でOISTタンパク質工学・進化ユニットのポストドクトラルスカラーであるサクニクテ・トレド・パティノ博士は、次のように締めくくっています。「アミノ酸約100個分の長さの小さなタンパク質ですが、その配列の組み合わせが宇宙の原子の数を超えるほどあるという事実は驚くべきことです。このため、自然界で見られる組合せは、そのごく一部に過ぎませんが、それでも生命維持に必要な膨大な数の反応を促すことができているのです。」
本研究成果は、人工酵素の設計に役立つ可能性があり、そのような酵素は様々な用途への応用が期待されています。
論文情報
- 論文タイトル: Insertions and deletions mediated functional divergence of Rossmann fold enzymes
- 著者:Saacnicteh Toledo-Patiño, Stefano Pascarelli, Gen-ichiro Uechi and Paola Laurino
- 所属:沖縄科学技術大学院大学
- 発表先: Proceedings of the National Academy of Sciences of the United States of America (PNAS)
- DOI:10.1073/pnas.2207965119
- 掲載日: 2022年11月23日