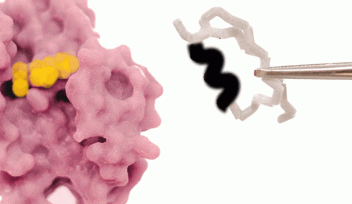
特徴的なβターン構造が酵素スーパーファミリーをよりパワフルに
細胞というものは、忙しく動く工場のようにスムーズなオペレーションを維持するため、たくさんの働き手を必要としています。メチルトランスフェラーゼ、別名MTaseとして知られている酵素のスーパーファミリーは、遺伝子発現の制御や、細胞産物の修飾、また、細胞をカスケードするシグナル調節をします。MTaseの構造は、正しく仕事を行うための適切なツールを備えており、科学者たちはその構造を理解することで、ツールの最適化や、新しいツールへの交換が可能になります。
この度、沖縄科学技術大学院大学(OIST)の研究者らは、「ロスマンフォールド」として知られる、最も巨大な分類のMTaseの重要な特徴の一つを明らかにしました。
「ロスマンフォールドは、自然界でも非常に豊富にあり、多くの種類のタンパク質でも見られます。しかしこの酵素のどこが他と異なるのか、それこそが問題だったのです」と、パオラ・ラウリーノ准教授率いるタンパク質工学・進化ユニットのポスドクで、本研究の筆頭著者であるパヌ・プラタップ・チョハン博士は説明します。
研究チームは、ロスマンMTaseの反応中心ループに存在し、機能上決定的に重要なある構造をピンポイントで特定しました。本研究成果は2018年11月8日付の Biochemistry 誌に掲載されました。

ループ領域が変化
αヘリックスおよびβストランドとして知られる二次構造をつなげるタンパク質内の「ループ」状の鎖は、一般的に非常に柔軟性があります。研究者らは、これらループ領域に突然変異を誘発させ、タンパク質の構造および機能を変化させることにより、そのメカニズムについて理解を深めています。
「ループ領域は、非常に進化が可能な領域と考えられています。というのも、ループ領域は変異に対してより耐性があり、タンパク質機能を完全に阻害せずに進化させられる事が可能だからです」と、チョハン博士は語ります。今回の研究では、ロスマンMTaseの主要構成要素をより良く理解し、将来、これらのタンパク質成分を修飾可能にすることを目指しました。
今回研究者たちは、公開されているタンパク質データバンクを使用し、190以上のロスマンMTase構造の比較を行いました。そして、ロスマンMTase構造の90%以上が、1つの特定のループ領域に共通の構造的特徴を持っていることを発見したのです。
「このループ領域が、特定の3次元配向に適応し、特定のマーカーとして機能することを示すことができました」と、チョハン博士は説明します。4つのアミノ酸が、タイプIIのβターン構造として知られているマーカーを構成し、ループの安定性を保っていると考えられており、この安定性は、酵素の機能を助けます。なぜなら酵素が機能するためには、その存在が不可欠な物質である「補助因子」がループ付近に存在しなければならず、補助因子のわずかな硬直性が、酵素をその場に固定させるからです。ロスマンMTaseは、このような精密な配置により、主要目的である、DNA、RNA、タンパク質、小分子、脂質を化学的に修飾し、それらの機能調節ができるのです。

主要な構造的特徴が高度に保存
多くの酵素が、このロスマンフォールドを内包していますが、これらの酵素すべてがMTaseであるとは限りません。そこで、ロスマンフォールドMTaseをその他のロスマンフォールド酵素と比較したところ、ロスマンフォールドMTaseにおいてこのβターン構造が、その他の酵素よりも顕著に見られることがわかりました。これはつまり、βターン構造がロスマンMTaseに特異的なものであり、機能の一部となっていることを示唆するものです。
このことを検証するため、科学者たちは、βターンが突然変異して主要な構造的特徴を失った場合、何が起こるかをシミュレーションしました。そして、βターン領域が変化すると、ロスマンMTaseは安定性を失うらしい、ということがわかりました。
さらに、実際にロスマンMTaseにおいて、化学物質を混ぜ合わせる実験を通し、シミュレーション結果の検証を行いました。通常実験では、タンパク質への突然変異、進化、新機能の付加が可能です。しかしながら、機能に含まれるタンパク質に不可欠な要素を変異させた場合でも、強い選択圧がたんぱく質にかかり、その変異を補正させてしまいます。そこで研究者らは、約百万個の変異したロスマンMTaseのライブラリを作製し、進化のわずか3ラウンド内で、すべての修飾されたβターン構造が、本来の構造に戻ることを発見しました。
本研究成果は、このようなロスマンMTaseの特徴が、高度に保存され、酵素の機能にとって必要不可欠であることを示しています。構造と機能の相関性が明らかになることで、科学者らは新たなロスマンMTaseをより効率的に設計できるようになるかもしれません。
「基本的に本研究結果は将来、MTaseのループを設計するためのテンプレートを提供し得るもの、と考えられるでしょう」と、チョハン博士は今後の展望を述べています。
研究ユニット
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム