アルツハイマー病におけるタウ・タンパク質の役割を解明
本研究のポイント
- アルツハイマー病に関わるタンパク質で、「微小管」という細胞の構造を作る線維に結合する「タウ・タンパク質」が、マウスの脳内でシナプス間の信号伝達を低下させることが本研究で明らかになった。
- シナプス前細胞の「シナプス前末端」にタウ・タンパク質を注入すると、多くの微小管が新たに生成される。
- 微小管の新たな生成が過剰に起こると、「エンドサイトーシス」が阻害され、信号伝達のために必須なシナプス小胞の再形成が損なわれる。
- エンドサイトーシスは、その過程で重要な役割を果たす「ダイナミン」というタンパク質が、過剰な量の微小管に結合して機能しなくなるために阻害される。
- 本研究では、PHDP5と呼ばれる小分子のペプチドを使用すると、ダイナミンが微小管に結合するのを防ぎ、シナプスの信号伝達をほぼ正常な状態にまで回復させることが示された。PHDP5はアルツハイマー病の新しい治療薬法となる可能性がある。
プレスリリース
アルツハイマー病は、神経細胞が死滅し、記憶力や思考力が徐々に損なわれる脳疾患です。認知症の中で最も多く、世界で約5,000万人の患者がいると推定されています。超高齢化社会を迎えた日本にとっては特に深刻な問題です。しかし、その原因はまだ十分に解明されておらず、治療法も限られています。
アルツハイマー病に深く関わる「タウ」というタンパク質の量がマウスの脳内で過剰になると、神経の細胞同士で行われる信号の伝達が損なわれることを、この度国内の研究チームが明らかにしました。科学誌eLifeに発表された本成果によって、アルツハイマー病など神経細胞に障害が起こる「神経変性疾患」の症状を治療できたり、進行を止めたりするなど、新たな道が開かれる可能性があります。
神経細胞で生成されるタウ・タンパク質は、細胞の構造を保ち細胞内の物質の輸送経路としても使われる細長いフィラメント(筒状の線維)である「微小管」に結合し、集合体を形成する「重合」に役立ちます。通常、タウ・タンパク質は、微小管に結合した状態で存在するか、細胞の中を埋める液体中に溶けこんでいます。
しかし、特にアルツハイマー病などの一部の神経疾患では、溶けやすい「可溶性タウ・タンパク質」の濃度が脳の特定部位で過剰になり、凝縮して溶けにくい不溶性の「神経原線維変化」と呼ばれる構造を形成してしまいます。
本研究の責任著者であり、OISTの細胞分子シナプス機能ユニットを率いる高橋智幸教授は、次のように述べています。「多くの研究者は、アルツハイマー病の目に見える特徴である神経原線維の塊が及ぼす影響に注目していますが、認知機能の低下と最も密接な相関があるのは、実は目に見えない可溶性タウなのです。」
この研究が始まったのは、10年前のことでした。当時、高橋教授の研究チームは、哺乳類の脳で最大のシナプスであるHeldの萼(ヘルドのがく)状シナプスで行われる信号伝達に、高濃度の可溶性タウ・タンパク質が及ぼす影響を研究していました。シナプスでは、2つの神経細胞が接触して通信を行います。電気信号がシナプス前細胞の末端に到達すると、「小胞」と呼ばれる膜の袋から「神経伝達物質」と呼ばれる化学物質が神経細胞間の間隙に放出されます。神経伝達物質がシナプス後細胞に到達すると、新たな電気信号が作られます。
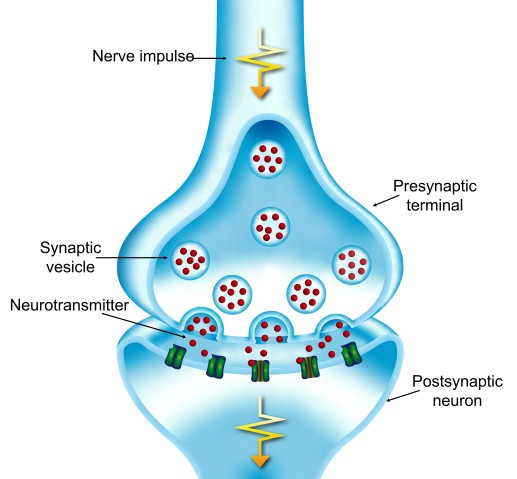
高橋教授の研究チームがマウスのHeldの萼状シナプスの前末端に可溶性タウ・タンパク質を注入したところ、シナプス後細胞での電気信号の生成が劇的に低下することを発見しました。
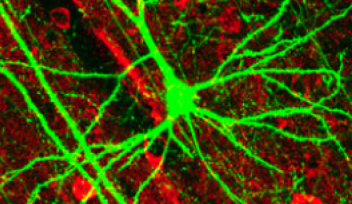
その後、タウ・タンパク質と微小管を蛍光標識して観察したところ、タウ・タンパク質を注入するとシナプス前末端内で多くの微小管が新たに重合することを確認しました。
しかし、微小管の重合に関わる結合部位を欠いた変異型のタウ・タンパク質を代わりに注入すると、シナプスの信号伝達には影響がみられませんでした。
「シナプス信号の減少と新たな微小管重合の間に明らかな関連があることがわかったのです」と高橋教授は説明します。
さらに、第二の重要な手がかりとして、タウ・タンパク質の増加によって低下するのが高周波信号の伝達のみであり、低周波信号の伝達は変化しないことが明らかになりました。高周波信号は、一般に認知や運動の制御に関わるものです。
研究チームは、このように高周波伝達にのみ選択的に影響が出る理由として、シナプス小胞のリサイクルが阻害されているためではないかと推測しました。
シナプス小胞のリサイクルは、シナプス伝達における非常に重要なプロセスです。なぜなら、シナプス小胞はシナプス前末端の膜と融合して伝達物質を「エクソサイトーシス(開口放出)」した後、「エンドサイトーシス(膜回収)」によって再形成され、神経伝達物質を再充填して、開口放出に再利用されるためです。シナプス小胞のリサイクルのいずれかの過程が阻害されると、多数の小胞開口を必要とする高周波信号はすぐに弱まってしまいます。
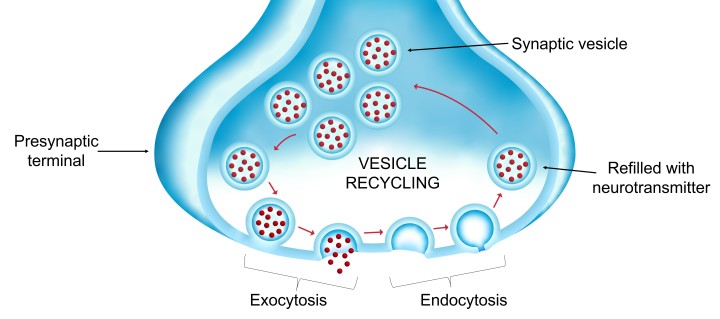
研究チームは、可溶性タウ・タンパク質の濃度が上昇すると、最初にエンドサイトーシスが阻害されることを見出しました。小胞が再形成されないとリサイクリングが損なわれ、二次的な影響によってで、エクソサイトーシスが低下することになります。
チームは、「ノコダゾール」という微小管の新たな重合を阻害する薬剤を使用することで、注入したタウ・タンパク質によるエンドサイトーシスの低下を防ぐことができるという重要な発見をしました。
研究チームは、次のステップとして、微小管の量が過剰になることでエンドサイトーシスが阻害される詳しい仕組みのにとりかかりました。
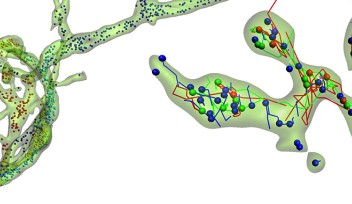
微小管とエンドサイトーシスの関連を探る中で、エンドサイトーシスの最終段階で小胞を表面の膜から切り離す役割を果たす大型のタンパク質「ダイナミン」が、実は微小管に結合するタンパク質として発見されていたことに気がつきました。しかし、その結合部位については、ほとんど何も明らかになっていませんでした。
研究チームがタウ・タンパク質、微小管、ダイナミンを蛍光標識して観察したところ、タウ・タンパク質を注入したシナプス前末端では、ダイナミンの結合が増加しており、エンドサイトーシスにおける役割を果たせなくなっていることが判明しました。
そこで研究チームは、ダイナミンと部分的にアミノ酸配列が一致する「ペプチド」を多種類合成し、これらのペプチドがダイナミンと微小管の結合を阻害することによって、タウ・タンパク質によるシグナル伝達の障害を防ぐことが可能かどうかをテストしました。その結果、ダイナミン部分ペプチドのひとつPHDP5をタウ・タンパク質と共に注入したところ、エンドサイトーシスとシナプス伝達がほぼ正常な状態に保たれることが確認されました。

今後、研究チームは、可溶性タウ・タンパク質の濃度が高いアルツハイマー病のモデルマウスにこのペプチドを投与する実験を行う予定です。これらのマウスは、生後6~8ヵ月頃に学習能力や新しい記憶の形成能力が低下しますが、このペプチドを投与することによって記憶障害の予防、または回復が可能となることを期待しています。
「そのためには、PHDP5を改変して、血液から脳組織への移行を制限する『血液脳関門』を通過できるようにする必要があります。このペプチドの有効性がモデルマウスで確認されれば、アルツハイマー病の有効な治療法となる可能性があります」と、高橋教授は締めくくっています。
論文情報
研究ユニット
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム