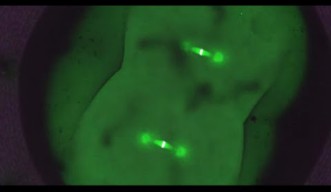
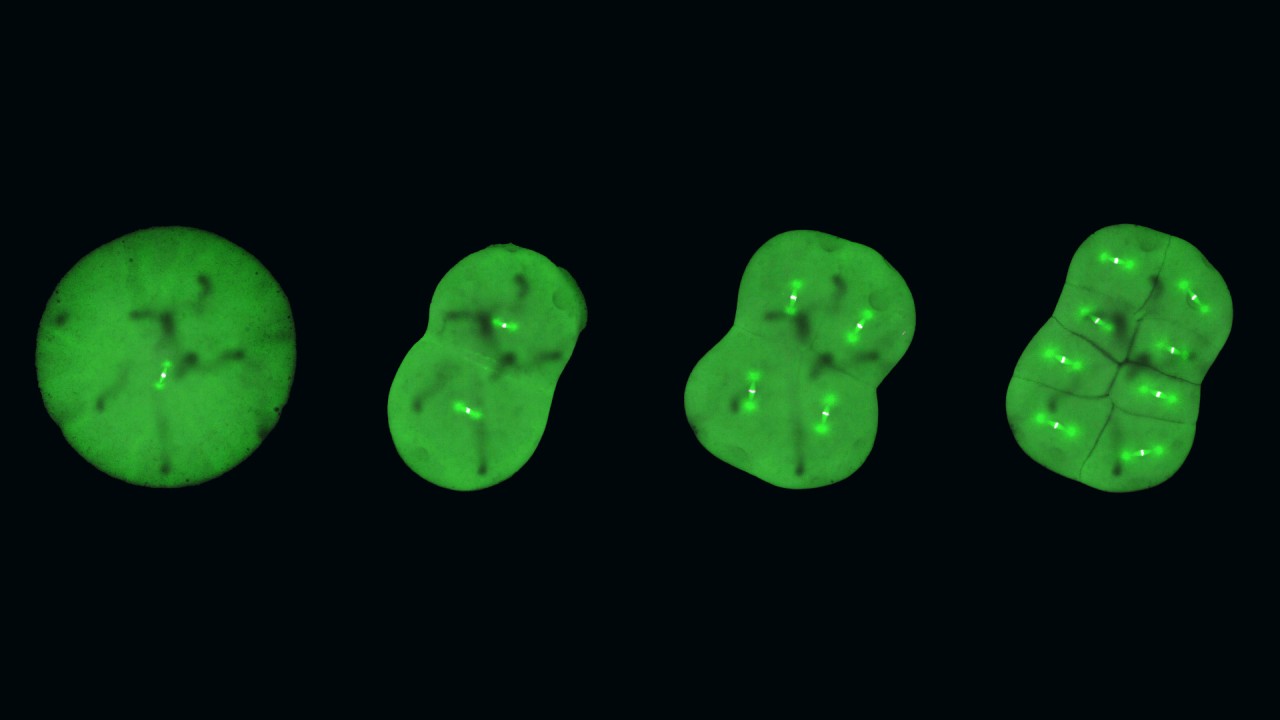
タイムラプス撮影で胚の細胞分裂の謎を解明
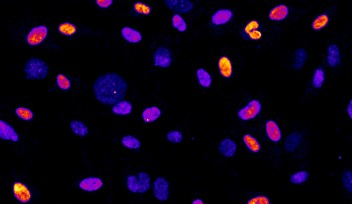
生命の誕生は謎に包まれています。有糸分裂の複雑な動態は、いわゆる体細胞(皮膚細胞や筋肉細胞のような特殊な機能を持つ細胞)ではよく研究されていますが、私たちの体の最初の細胞である胚細胞に関しては、いまだ解明されていません。脊椎動物における胚性有糸分裂の研究は困難であることが知られています。というのも、ライブイメージングでの機能解析が技術的に限られており、胚形成中の細胞を追跡することが難しいからです。
このほど、沖縄科学技術大学院大学(OIST)の細胞分裂動態ユニットの研究チームは、名古屋大学(現北海道大学)の西村俊哉助教、名古屋大学の田中実教授、東北大学(現京都大学)の安齋賢特定准教授、国立遺伝学研究所の鐘巻将人教授らと共に、学術誌『ネイチャーコミュニケーションズ』に論文を発表しました。本研究は、新しいイメージング技術、CRISPR/Cas9ゲノム編集技術、最新のタンパク質ノックダウンシステム、そしてモデル生物としてミナミメダカ(Oryzias latipes)を用いることによって、胚性有糸分裂の解明のための、最初の大きな一歩となりました。研究チームが作成したタイムラプスは、胚で染色体が均等に分かれる複雑なプロセスについての根本的な理解に役立つとともに科学的探求の次のフロンティアにつながります。本研究の責任著者である清光智美准教授は、タイムラプスについて次のように語っています。「タイムラプスの画像自体も美しいのですが、胚の有糸分裂の解明につながる新たな基礎を築いた点も評価できます。」
胚性有糸分裂の主な謎は、細胞のすべての遺伝情報を保持する染色体が整列し、娘細胞に均等分配されるという重要なステップにあります。このプロセスの鍵を握るのが有糸分裂の紡錘体です。紡錘体は微小管(細胞内の構造形成と輸送に使われる長いタンパク質繊維)でできており、紡錘体の両極から放射状に伸び、中央で染色体に接着します。紡錘体は複製された染色体を適切に捕らえ、分裂の際に娘細胞に均等に分配します。紡錘体の形成を決定する因子は数多くありますが、その一つにRan-GTPというタンパク質があります。Ran-GTPは、中心体(微小管を組み立てる役割を担う細胞小器官)を持たない女性の生殖細胞の分裂では必須の役割を果たしますが、中心体を持つ小さな体細胞では必須ではありません。しかし、Ran-GTPが脊椎動物の初期胚の紡錘体形成に必要であるかどうかは長い間不明でした。脊椎動物の初期胚には中心体がありますが、細胞サイズが大きいなどの特徴があります。
哺乳類の初期胚とは対照的に、魚類の胚細胞は透明で、均一な単細胞層で同時に分裂し、発生を進行するため、観察が極めて容易です。ミナミメダカは適応できる温度範囲が広く、毎日卵を産み、比較的小さなゲノムを持つため、研究に特に適した魚であることが分かりました。温度耐性があるということは、ミナミメダカの胚細胞は室温でも生存できるということであり、長時間生きたままでのタイムラプス撮影に特に適しています。
メダカは頻繁に卵を産み、ゲノムサイズが比較的小さいことから、CRISPR/Cas9を用いたゲノム編集に適しています。このゲノム編集の技術を用いて、実際に胚の有糸分裂に関与する特定のタンパク質の動態を可視化する遺伝子組み換えメダカを作り出しました。

遺伝子組み換えメダカの胚で、分裂中の有糸分裂紡錘体をタイムラプス観察したところ、大きな初期胚は体細胞紡錘体とは異なる独自の紡錘体を組み立てていることを発見しました。また、初期胚の分裂ではRan-GTPが紡錘体形成に決定的な役割を果たしますが、後期胚ではあまり重要ではありません。これは、発生の過程で細胞が小さくなるにつれ、紡錘体構造がリモデリングされるためと考えられますが、正確な理由については、さらなる研究が必要です。
研究チームはまた、ほとんどの体細胞に特徴的な、染色体が分離前に正しく整列するときの紡錘体チェックポイントが、初期胚細胞には存在しないことも発見しました。清光准教授は「チェックポイントが活性化していないにもかかわらず、染色体の分離は非常に正確なのです。これは、胚細胞が非常に速く分裂する必要があることで説明できるかもしれませんが、さらに研究を進める必要があります」と話します。
メダカの遺伝子組み換えと初期胚の研究は、胚性有糸分裂に関する新たな知見につながりましたが、清光准教授と研究チームにとって、これはほんの始まりに過ぎません。後期段階におけるRan-GTPの役割の減少や、紡錘体形成チェックポイントの欠落に関する疑問に加えて、清光准教授はタイムラプスにおける細胞分裂の対称性の面白さを指摘します。「紡錘体の形成は高度な対称性を特徴としています。細胞は等しい大きさになるように、かつ規則的な方向に分裂しているように見え、紡錘体は一貫して細胞の中心にあります。紡錘体はどのようにして規則正しく配向し、どのようにして毎回、細胞の中心を見つけることができるのでしょうか?」
タイムラプスだけでなく、研究チームは、胚細胞研究のモデルとなる遺伝子組み換えメダカの種類を増やし、この新しい基盤をさらに強固なものにすると同時に、ゲノム編集プロセスを最適化したいと考えています。最終的には、他の生物においても胚性有糸分裂を研究することで、今回の発見が一般化可能かどうかを検証し、次の段階では、紡錘体形成と胚分裂の進化を探求することで、ヒトの胚発生をより深く理解し、ヒト不妊症の診断・治療法の開発にも貢献したいと考えています。
「この論文で、確かな基礎が築けました」と清光准教授は総括します。「と同時に、新たなフロンティアも開かれました。胚性有糸分裂は美しく、神秘的で、研究しがいのあるものです。私たちの研究によって、生命の始まりの複雑なプロセスの理解に少しでも近づけることを願っています。」
論文情報
広報・取材に関するお問い合わせ
報道関係者専用問い合わせフォーム