がん細胞の「遊走」を食い止める新技術の開発
概要
この度、沖縄科学技術大学院大学(OIST)の研究員らは、がん細胞において活性化している細胞遊走(細胞の移動運動)を阻害する新しい技術を開発しました。Cell Press社の化学ジャーナルであるChem誌に掲載されたこの研究成果は、今後のがん治療における新手法となる可能性があります。
研究の背景と経緯
がん細胞が 浸潤、運動しながら体内を移動することは、私たちの健康を考える上で、がんがもたらす最大の脅威といえます。これまでの研究では、がん細胞に特異的、あるいは高発現する分子に着目し、細胞運動の制御や阻害をする研究を行ってきましたが、がん治療に有効な分子を同定することは大変困難でした。
研究内容
そこで、イェ・ジャン准教授が率いるOIST生体模倣ソフトマターユニットの研究者らが開発したのが、がん細胞膜上の脂質ラフト※1を標的にする技術です。
脂質ラフトは、細胞膜内で自由自在に浮かんでおり、細胞内外の情報伝達を担うドメインとされています。脂質ラフトは、細胞内部に複雑なネットワーク状の線維構造を形成する細胞骨格と結合しており、細胞骨格系は細胞遊走に必要であることがわかっています。このことから脂質ラフトを標的とすることは細胞遊走を制御、阻害する上で、理にかなっているのです。
今回の研究では、同ユニットに所属するグワンイン・リー博士とジャン准教授が、OISTイメージングセクションおよび機器分析セクション、日本電子株式会社(JEOL、東京都昭島市、栗原権右衛門代表取締役社長)の研究者らの協力のもとに行いました。
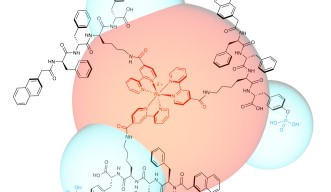
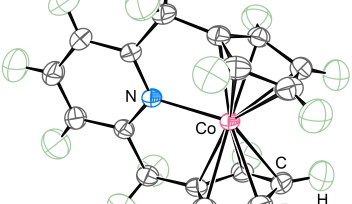
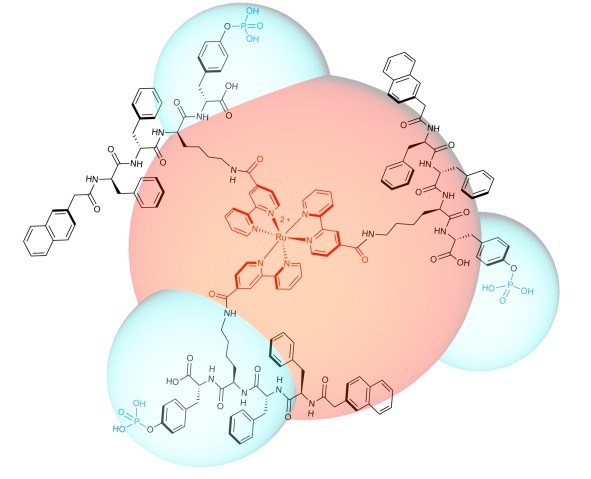
チームは、子宮頸がん細胞を認識して、物理的に細胞遊走を阻害する発光性分子を作製することに成功しました。この分子はルテニウム金属錯体を中核に、3次元レベルで3個のペプチドが自律的に集合した形になっています。
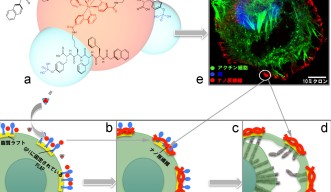
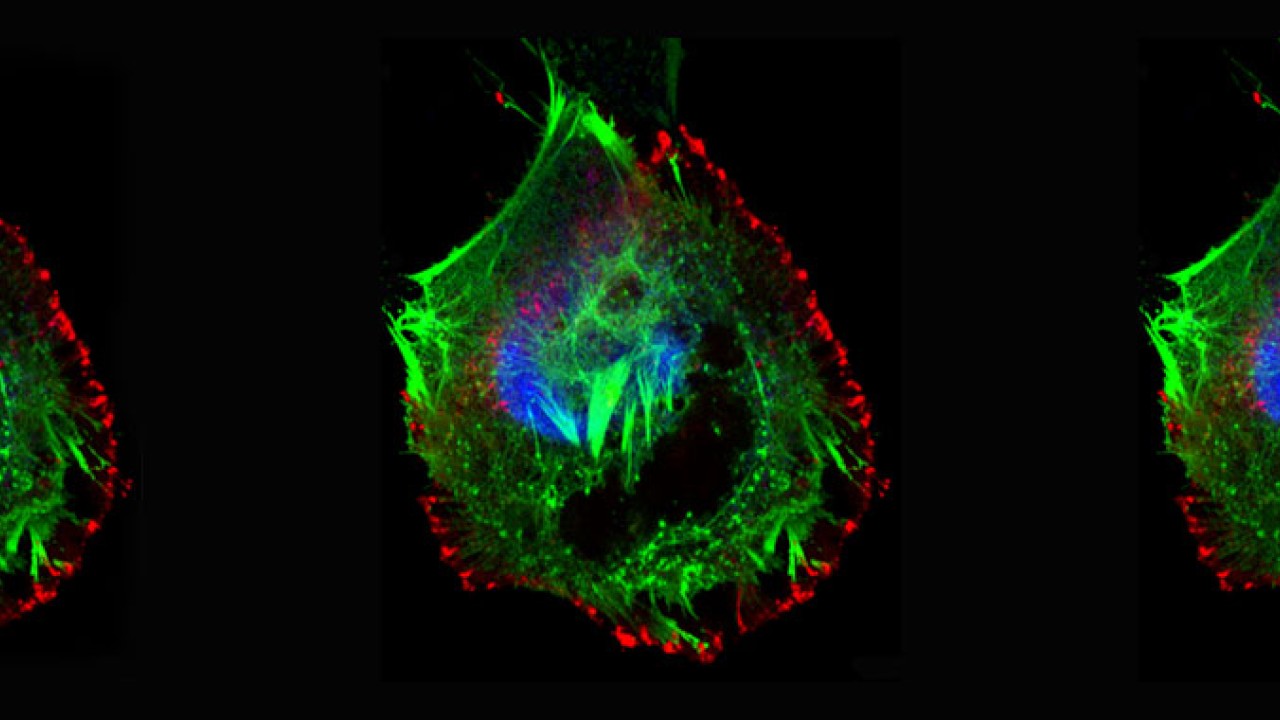
これらの分子構造物は、脂質ラフト上にあり、子宮頸がんの遺伝子マーカーとして知られるグリコシルフォスファチジルイノシトールアンカー胎盤アルカリフォスファターゼ(GPI-anchored PLAP)と相互作用する際、分子構造物が自律的に集合してナノレベルの繊維(ナノ繊維)を形成し、これにより脂質ラフト同士を結合させ、大きなクラスターを作ります。その結果、脂質ラフトに結合している細胞骨格が張力を受け、細胞がピンで留めたように固定され、運動が阻害されるようになります。
それに反応して、ガン細胞は逃れようとして、糸状仮足と呼ばれる突起物を伸ばします。すると糸状仮足の先端にも存在する脂質ラフトで同様にクラスターが形成され、新たに細胞がピンで留められたような状況になります。
この状況は、ガン細胞が逃れようとして細胞遊走しようとする限り続きます。ガン細胞は逃れようとして細胞体を広げようとすると、細胞の周縁部はナノ繊維によって固定されたままであるため、細胞体が薄く広げられます。この反作用として細胞の破裂が起こり、細胞死に至ります。
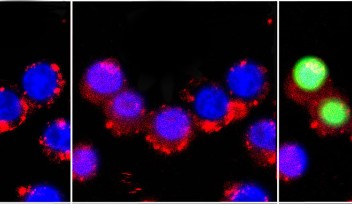
研究チームは、子宮頸がん細胞が固定され、伸張が起こり、細胞が破裂するまでの過程について細胞内小器官、部位を免疫染色により可視化して共焦点レーザー顕微鏡で観察するとともに、微細構造を高分解能の走査電子顕微鏡(SEM)で観察することに成功しました。

今回の研究成果のインパクト・今後の展開
ジャン教授は「私たちの研究は、子宮頸がん治療の分野において新たな風穴を開けました。」とした上で、「実験室での培養細胞系では私たちが作製した分子がうまく機能することを証明できましたが、次のステップは動物の体内で、実際の腫瘍にも同じように効果があるのかどうかを調べることです。それぞれのがんは、異なるバイオマーカーを持つので、将来的にはルテニウム分子の分子構造に修正を加えることで、異なるタイプのがん細胞を標的にすることが可能になるかもしれません。」と、動物実験を含む今後の研究の方向性を見据えています。
用語説明
※1脂質ラフト
細胞の表面に存在する、スフィンゴ脂質とコレステロールに富んだ脂質ドメイン。細胞膜における情報伝達、膜輸送、細菌やウイルスの感染に重要な役割を果たすと考えられている。