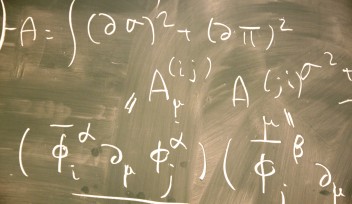RhoA/Rhoキナーゼを介した小胞エンドサイトーシス制御機構

OIST細胞分子シナプス機能ユニット(高橋智幸教授)のザカリ・タウフィック研究員と江口工学研究員はそれぞれの専門の生化学と電気生理学の手法を組み合わせ、Rhoキナーゼという酵素が神経細胞間の情報伝達を調節する重要な分子であることを発見しました。
通常シナプスではシナプス前末端から後膜への一方通行の情報伝達が行われていますが、シナプス後膜から前末端への逆行性の情報伝達が起こることがあります。以前の研究では、この逆行性の情報伝達がシナプス前末端での小胞エンドサイトーシスを制御していることを報告しました。シナプス前末端から放出された神経伝達物質(グルタミン酸)は、シナプス後膜のNMDA受容体(NMDAR)に結合します。グルタミン酸を受け取ったNMDARは細胞内へとカルシウムイオンを流入させます。流入したカルシウムイオンはカルモジュリン(CaM)を、CaMはNO合成酵素(NOS)を活性化し、NOを生成します。NOは細胞膜を透過してシナプス前末端へと拡散し、前末端にある水溶性グアニル酸シクラーゼ(sGC)を活性化します。sGCが活性化するとサイクリックGMP(cGMP)を生成し、cGMP依存性プロテインキナーゼ(PKG)を活性化します。活性化したPKGはシナプス前末端内のPIP2濃度を上げ、小胞エンドサイトーシスを促進します。今回の研究では、このPKGとPIP2を単量体G蛋白質RhoAと、RhoAによって活性化するプロテインキナーゼ(Rhoキナーゼ)とが仲介していることを発見しました。
本研究の成果は、2013年7月17日付けのJournal of Neuroscienceに掲載されました。
Copyright OIST (Okinawa Institute of Science and Technology Graduate University, 沖縄科学技術大学院大学). Creative Commons Attribution 4.0 International License (CC BY 4.0).
タグ